aminas
concepto:Las aminas son compuestos químicos orgánicos que se
consideran como derivados del amoníaco y resultan de la sustitución de uno o
varios de los hidrógenos de la molécula de amoniaco por otros sustituyentes o
radicales. Según se sustituyan uno, dos o tres hidrógenos, las aminas son
primarias , secundarias o terciarias, respectivamente.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos OCNR polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos OCNR polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.

ejemplo
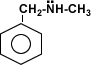
Aminas primarias: etilamina, anilina.
Aminas secundarias:d dimetilamina, ietilamina,
etilmetilamina.
Aminas terciarias: trimetilamina, dimetilbencilamina.

PROPIEDADES
Propiedades Físicas:
Las aminas son compuestos incoloros que se oxidan con
facilidad lo que permite que se encuentren como compuestos coloreados. Los
primeros miembros de esta serie son gases con olor similar al amoníaco. A
medida que aumenta el número de átomos de carbono en la molécula, el olor se
hace similar al del pescado. Las aminas aromáticas son muy tóxicas se absorben
a través de la piel.
 Amina secundaria aromática | Amina terciaria aromática |
Solubilidad: Las aminas primarias y secundarias son
compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el
agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas
con más de 6 átomos de carbono y en las que poseen el anillo aromático.
Punto de Ebullición: El punto de ebullición de las aminas es
más alto que el de los compuestos apolares que presentan el mismo peso
molecular de las aminas. El nitrógeno es menos electronegativo que el oxígeno,
esto hace que los puentes de hidrógeno entre las aminas se den en menor grado
que en los alcoholes. Esto hace que el punto de ebullición de las aminas sea
más bajo que el de los alcoholes del mismo peso molecular.
|
(Constantes físicas de algunas Aminas)
|
|||||||||||||||||||||||||||||||
|
Propiedades Químicas De Las Aminas:
:) Estructura Molecular:
El átomos de nitrógeno en amonas posee una hibridismo sp3 y dos electrones desaperados por lo que estos compuestos presentan una estructura tetragonal, el centro lo constituye el nitrógeno y posee vértices de 109°.
Basisidad:se comportan como acatares de protones o iones de H, lo cual los convierte en bases. Cuando se encuentran en solución o cosa, se establece un equilibrio en el cual el agua actúa como ácido donado un proton que es aceptado por la amina.
Formación de sales:
una consecuencia de se de carácter básico es que reaccionan con ácidos tanto orgánicos como inorgánicos para formar sales .
Acilacion y alquilacion:
La acilacion es la incorporación de un grupo amina (-NH2- o RNR) a una ácido que la alquilacion es una incorporación de un grupo amino a una radical, algunos en el primer caso se convierten en acido carboxilico.
:) Las aminas se comportan como bases . cuando una amina se disuelve en agua acepta un proton formando un ion alquil-amoniaco.
:) Síntesis de aminas las aminas se obtienen tratando derivados halogenados o alcoholes con amoniaco

:) Estructura Molecular:
El átomos de nitrógeno en amonas posee una hibridismo sp3 y dos electrones desaperados por lo que estos compuestos presentan una estructura tetragonal, el centro lo constituye el nitrógeno y posee vértices de 109°.
Basisidad:se comportan como acatares de protones o iones de H, lo cual los convierte en bases. Cuando se encuentran en solución o cosa, se establece un equilibrio en el cual el agua actúa como ácido donado un proton que es aceptado por la amina.
Formación de sales:
una consecuencia de se de carácter básico es que reaccionan con ácidos tanto orgánicos como inorgánicos para formar sales .
Acilacion y alquilacion:
La acilacion es la incorporación de un grupo amina (-NH2- o RNR) a una ácido que la alquilacion es una incorporación de un grupo amino a una radical, algunos en el primer caso se convierten en acido carboxilico.
:) Las aminas se comportan como bases . cuando una amina se disuelve en agua acepta un proton formando un ion alquil-amoniaco.
:) Síntesis de aminas las aminas se obtienen tratando derivados halogenados o alcoholes con amoniaco
:) las propiedades químicas del aminas son parecidas a las de los amoniacos, al igual que estas son sustancias básicas, son aceptares de protones según la definición de Bronsted.
:) Las aminas presentan reacciones neutralizadas con los ácidos y forman sales de alquilamonio ( también denominadas sales de aminas)

REACCIONES
REACCIONES QUÍMICAS
Reacciones o comportamiento de las amina
La reacción con el ácido nitroso permite diferenciar entre aminas primarias, secundarias y terciarias. Así:
EJEMPLOS
CH3-NH2+HCL-->CH3NH3+Cl
La reacción con el ácido nitroso permite diferenciar entre aminas primarias, secundarias y terciarias. Así:
- Las aminas primarias reaccionan con desprendimiento de nitrógeno:
| R—CH2—NH2 + HONO | R—CH2OH + N2 + H2O | |
| amina primaria | alcohol |
- Las aminas secundarias reaccionan lentamente en caliente con el ácido nitroso formando nitrosaminas con apariencia aceitosa:
| R—NH—R' + HONO | R—NNO—R' + H2O | |
| amina secundaria | nitrosa mina |
- Las aminas terciarias tratadas con exceso de ácido nitroso conducen a la formación de nitritos:
| R—NR'—R'' + HONO | R—N(R')HNO2—R | |
| amina terciaria | nitrito de trialquilamonio |
metilamina cloruro de metil-amonio
CH3CH2-NH2+H2SO4 --> CH3-CH2-NH3+HSO4
etilamina sulfato acido de etil-amonio
CH3-NH + HCl--< CH3-NH2Cl
CH3 CH3
dimetilamina cloruro de dimetil-amonio
O O
O O
CH3-NH2 + CH3-C-OH ---> CH3NH3-O-C-CH3
metilamina acido acetico acetato de metil-amonio
NOMENCLATURA
Regla 1. Las aminas se pueden nombrar como derivados de alquilaminas o alcanoaminas. Veamos algunos ejemplos.

Regla 2. Si un radical está repetido varias veces, se indica con los prefijos di-, tri-,...
Si la amina lleva radicales diferentes, se nombran alfabéticamente.

Regla 3. Los sustituyentes unidos directamente al nitrógeno llevan el localizador N. Si en la molécula hay dos grupos amino sustituidos se emplea N,N'.

REGLA 4 Cuando la amina no es el grupo funcional pasa a nombrarse como amino-. La mayor parte de los grupos funcionales tienen prioridad sobre la amina (ácidos y derivados, carbonilos, alcoholes)


Regla 2. Si un radical está repetido varias veces, se indica con los prefijos di-, tri-,...
Si la amina lleva radicales diferentes, se nombran alfabéticamente.

Regla 3. Los sustituyentes unidos directamente al nitrógeno llevan el localizador N. Si en la molécula hay dos grupos amino sustituidos se emplea N,N'.

REGLA 4 Cuando la amina no es el grupo funcional pasa a nombrarse como amino-. La mayor parte de los grupos funcionales tienen prioridad sobre la amina (ácidos y derivados, carbonilos, alcoholes)

Experimentos sencillo de hacer
https://youtu.be/LnX7ZV2lQUg
BIBLIOGRÁFIA:*Química Orgánica MONDRAGON MARTINEZ, Cesar Humberto Editorial santillana 2005
*Enciclopedia Química LOPEZ Andres Editorial Voluntad 1999
*La gran enciclopedia Ilustrada CASTELLANOS, Anne Editorial Voluntad 2003
* Química 11º CASTALLEDA, Carlos Editorial Norma 2009
* Quimica Avanzada CONTRERAS Editorial Voluntad 2007

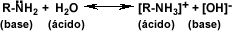
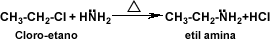

No hay comentarios:
Publicar un comentario